當前位置:河北廣吉玻璃鋼有限公司>>脫硝工程>>玻璃鋼脫硝設備>> 一體化脫硝工程 脫硫脫硝輔助設備
1





雙塔串聯式脫硫脫硝設備
脫硫脫硝雙塔串聯式獨立處理設備的的設計、制造、施工、安裝、調試、實驗試運行及驗收,交付用戶。符合國家環境治理要求以及新版的ISO標準,達到國家和當地環保規定的鍋爐大氣排放標準;
《污水綜合排放標準》(GB211627-2008)
《工業企業廠界噪聲標準》(GB12348-2008)
《工業企業設計衛生標準》(GBZ1-2002)
《混凝土結構設計規范》和1993年局部修訂(GBJ10-2002)
《鋼結構設計規范》(GB50010-200)
《建筑地基基礎設計規范》(GB50007-2002)
《低壓配電裝置規范》(GBJ54-83)
SON脫硫脫硝除塵系統布置滿足系統整體布置要求;
確保SON脫硫脫硝除塵系統不影響原煤燃燒氣爐的正常運行;
SON脫硫脫硝除塵裝置使用壽命長、操作維護簡單,布置緊湊、占地面積小; 在滿足系統各項指標的前提下,盡可能降低工程投資和運行成本。
雙塔串聯式脫硫脫硝技術
(1)雙塔中脫硫工藝采用鎂法脫硫技術,脫硝采用氧化法脫硝技術,除塵采用雙膜微電除塵技術。
(2)本裝置中的核心設備脫銷塔、脫硫塔中的噴淋層及防邊際效應圈為我公司技術,提高脫銷、脫硫效率的同時降低噴淋霧群對吸收塔塔壁的沖刷;每層噴淋噴嘴經過詳細布置和CFD流場模擬,可使脫硫塔斷面上實現均勻的噴淋效果,以達到脫銷、脫硫*效果;我公司設計的噴淋層,平時只運行一層就可以達到效果,設置第二層為備用,減少運行費用,以備排放更低時的需要。
(3)雙塔設備年運行小時按2880h考慮;
(4)雙塔裝置運行率不小于98%,裝置服務壽命為12年以上;
(5)設計保證脫硫裝置的煙氣處理能力為工況時75%~110%的煙氣量,設計保證值為吸收塔出口二氧化硫濃度、氮氧化物濃度、塵等排放物達標排放。
圖2 脫硫漿液處理工藝流程簡圖
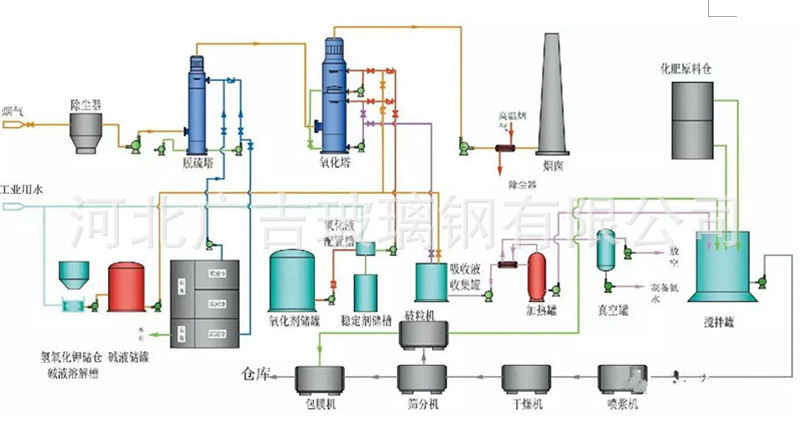


1.設計必須符合適用的要求:選擇的處理工藝、構筑物(建筑物)型式、主要設備、設計標準和數據等,應zui大限度地滿足使用的需要,以保證煙氣脫硫系統功能的實現。在充分尊重用戶需求和環境保護管理部門意見的同時,認真執行國家有關法規、標準及規定。
2.設計應符合經濟的要求:選擇的處理工藝應能滿足系統需要和要求,并盡可能降低運行費用。設計中一方面盡可能選用質優價廉的設備,以及采用合理措施降低工程造價;另一方面又必須保證在工程建成投入使用后,取得zui大的經濟效益和使用效果。
3.技術應當力求、合理:設計中必須根據生產的需要和可能,在經濟合理的原則下,盡可能采用技術。在機械化、自動化與儀表化程度方面,要從實際出發,根據需要和可能及設備的供應情況,妥善確定。
4.實用、美觀,避免二次污染:平面布置和建、構筑物形式力求與廠區其它建筑和環境協調*。整個系統設計應充分考慮設備噪聲、處理藥劑等可能造成的二次污染。
5.不影響煅燒爐正常運行:脫硫脫硝除塵系統工作時不影響煅燒爐的正常運行,并保證在給定設計條件下,確保煙氣中污染物達標排放。裝置使用壽命長、操作維護簡單,布置緊湊、占地面積小。處理設施有較高的耐沖擊負荷能力,并能在寒冷氣候條件下正常運行。
雙塔串聯式脫硫脫硝工藝原理
鎂法脫硫工藝原理
鎂法脫硫工藝是鎂的堿性氧化物與水反應生成氫氧化物,再與二氧化硫溶于水生成的亞硫酸溶液進行酸堿中和反應,氧化鎂反應生成的亞和,亞氧化后生成。脫硫過程中發生的主要化學反應有
MgO+H2O→Mg(OH)2
Mg(OH)2+SO2→MgSO3+H2O
MgSO3+H2O+SO2→Mg(HSO3)2
2MgSO3+O2→2MgSO4
鎂法脫硫副產物為,本方案回收采用七水的精制工藝得到工業級七水。
脫硫漿液處理工藝原理
先對脫硫漿液進行氧化,使脫硫產物亞氧化為。反應方程式如下:
然后去除溶液中的雜質,稀溶液再進入蒸發器加熱室,利用外加動力進行循環,有效增加對流傳熱系數,減少換熱面積。運行過程中即使溶液有晶體析出,系統也能正常使用,不易結垢。冷凝器采用間接冷凝,二次蒸汽冷凝為液態后可返回其他系統再利用。冷卻結晶器降低溶液溫度,同時溶解度下降,在特定溫度條件下溶液中析出七水晶體,經離心機分離后,可得到七水晶體。化學反應方程式為:
3脫硝原理
脫硝采用氧化法脫硝技術,煙氣中NOx的氧化度低時,用堿液吸收NOx的吸收效率不高。為提高吸收效率,先用氧化劑先將NOx中的部分NO氧化,以提高NOx的氧化度后,再用堿液吸收。氧化劑有O2、O3、Cl2等氣相氧化劑和HNO3、KMnO4、NaClO2、NaClO、H2O2、KBrO3、K2Cr2O7等液相氧化劑。采用氧化、堿吸收時,在堿性溶液中NO與NaClO2的反應如下:
NaClO2 →Na++ClO2-
2NO+ClO2-→2NO2+Cl-
NO+ClO2- →NO2+ClO-
4NO2+ClO2-+4OH- →4NO3-+Cl-+2H2O
2NO2+ClO2-+2OH- →2NO3-+ClO-+2H2O
因為生成了HNO3,溶液pH值在短時間內迅速下降,而NaClO2在酸性溶液中會分解,其反應過程如下:
ClO2-+H+ →HClO2
8HClO2→6ClO2+Cl2+4H2O
2ClO2-+Cl2 →2Cl-+ClO2
4ClO2-+2H+→ 2ClO2+ClO3-+Cl-+2H2O
NO的氧化反應如下:
4NO+3ClO2-+2H2O →4HNO3+3Cl-
5NO+4HCl →4ClO2+5Cl-+2H2O
5NO+3ClO2+4H2O →5HNO3+Cl-
反應生成的氮氧化物被吸收:





請輸入賬號
請輸入密碼
請輸驗證碼
以上信息由企業自行提供,信息內容的真實性、準確性和合法性由相關企業負責,環保在線對此不承擔任何保證責任。
溫馨提示:為規避購買風險,建議您在購買產品前務必確認供應商資質及產品質量。